Bài viết hôm nay là thông tin đầy đủ về bảng tính tan hóa học axit, bazơ, muối hóa học lớp 8, 9, 10 kèm theo một số bài tập ví dụ hay cho học sinh.
Bảng tính tan hóa học là gì?
Khi nhắc tới Hóa học, người ta nghĩ ngay đến bộ đôi bàn “trụ”, bộ đôi quan trọng nhất dường như được học sinh sử dụng mỗi năm học, đặc biệt là học sinh cấp hai khi mới vào lớp. Làm quen với Hóa học – tức là “Bảng tuần hoàn” và “Bảng tính độ hòa tan”. Trong bài viết này chúng tôi sẽ giúp các bạn có cái nhìn tổng quát và cụ thể hơn về Bảng tính hòa tan trong Hóa học và chỉ cho các bạn một số mẹo để có thể ghi nhớ và vận dụng, phát huy hết tiềm năng và tầm quan trọng tối đa của chúng trong quá trình học tập. Hãy tham khảo chế độ ngoại tuyến
Bảng tính tan là gì?
Bảng tính Độ hòa tan là biểu đồ dùng để thể hiện độ hòa tan hoặc không hòa tan của một chất (muối, bazơ hoặc axit) trong nước. Chất này có thể hòa tan, ít tan hoặc không hòa tan. Bảng tính độ hòa tan hóa học tiêu chuẩn sẽ hiển thị trạng thái hòa tan hoặc không hòa tan của một chất ở 25,15°C (hoặc 293,15°K) dưới áp suất 1 atm.
Bảng tính tan của các Axit – Bazơ – Muối trong nước
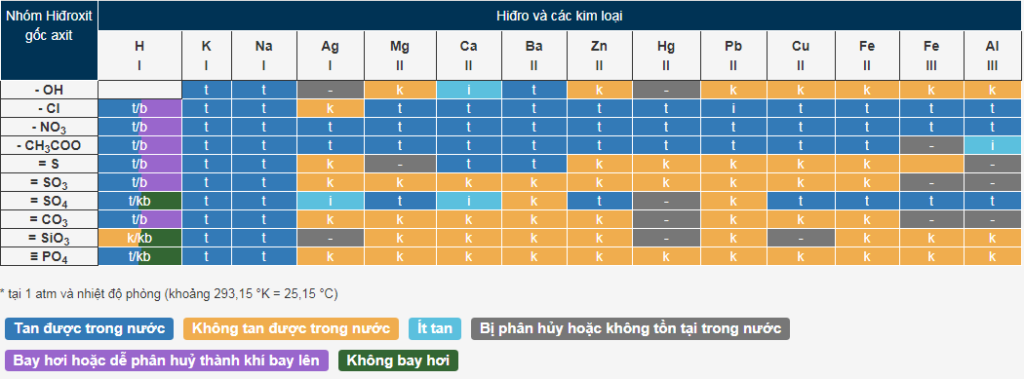
Trong đó:
- t là hợp chất tan trong nước.
- k: hợp chất không hòa tan.
- i: hợp chất ít tan.
- b: các hợp chất dễ bay hơi hoặc dễ phân hủy thành khí bay lên.
- kb: hợp chất không bay hơi.
- đường ngang “–”: hợp chất không tồn tại hoặc phân hủy trong nước.
Cách đọc bảng tính tan

-> Độ tan trong nước của chất này
– Hợp chất tạo thành từ kim loại Na(I) và nhóm hiđroxit (–OH) là NaOH, hợp chất này tan trong nước.
– Tương tự ta có: AgCl(k) không tan trong nước, Ag2SO4(i) ít tan trong nước, HCl (t/b) là hợp chất tan trong nước và dễ phân hủy thành khí khi bay lên, H2SO4 (t/b) b) kb) là hợp chất tan trong nước và không bay hơi, AgOH (-) là hợp chất không tồn tại.
Dạng bài tập mẫu sử dụng bảng tính tan hóa học
Phân biệt, cách nhận biết các chất
Đây là một trong những ứng dụng rất điển hình của bảng tính tan .
Phương pháp giải quyết
- Bước 1: Tạo mẫu thử – Chia các chất cần phân biệt vào các ống nghiệm và đánh số thứ tự.
- Bước 2: Chọn thuốc thử thích hợp (dựa trên yêu cầu của bài toán).
- Bước 3: Thả thuốc thử vào ống nghiệm, quan sát hiện tượng xảy ra (kết tủa, bay hơi, đổi màu…), từ đó rút ra kết luận về tên gọi của chất.
- Bước 4: Viết phương trình toán học bằng hình ảnh.
Cách nhận biết một số chất thông dụng
Đối với chất khí.
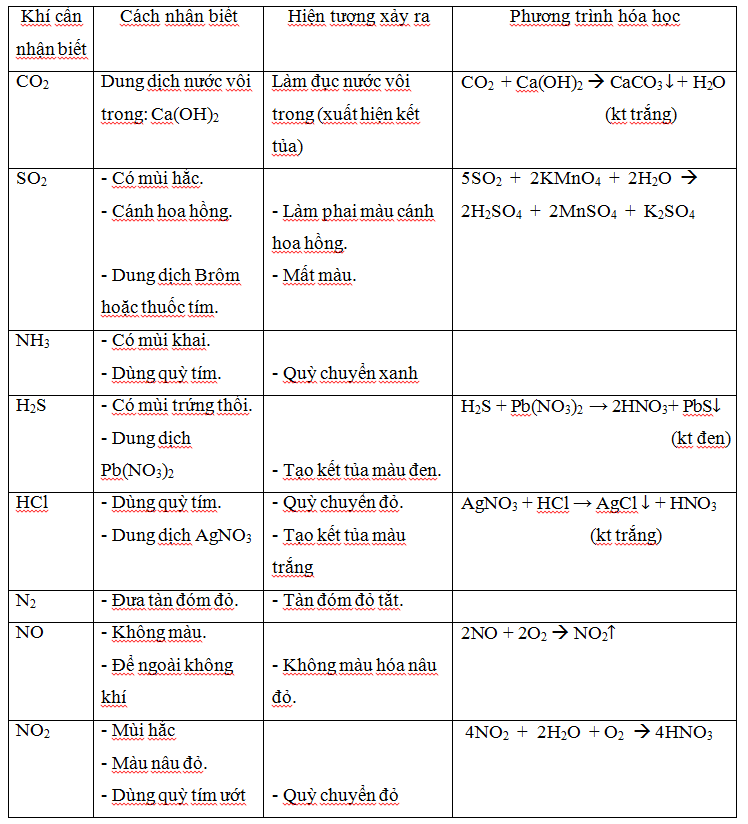
Xác định các dung dịch bazơ (kiềm):
Nhận biết chung: Làm cho hoa hướng dương đỏ chuyển sang màu xanh.
Một số cách khác:
Nhận biết chung: biến hoa hướng dương đỏ thành màu đỏ
Một số cách khác:
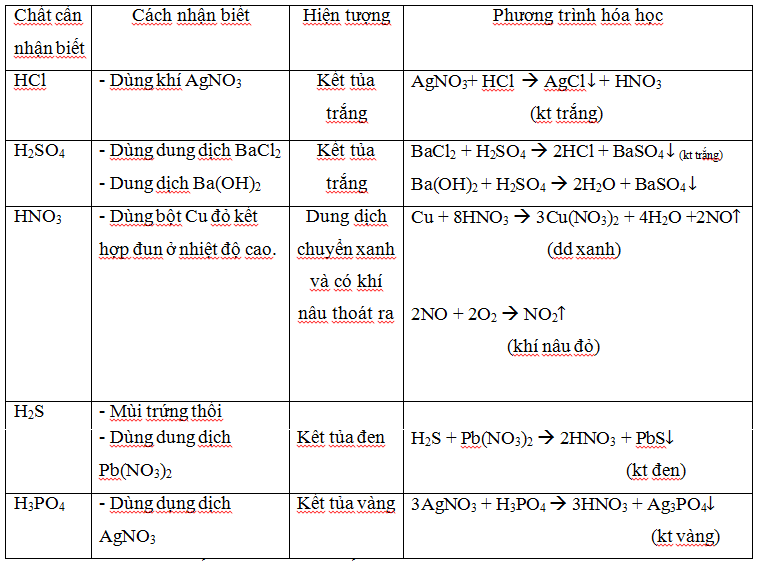
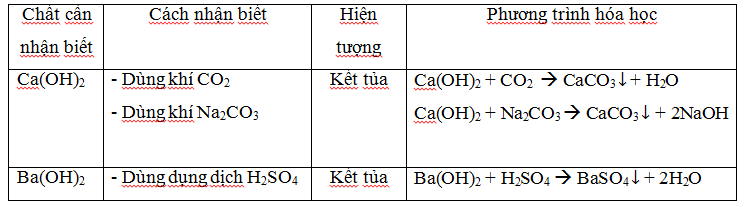
Xác định dung dịch muối.
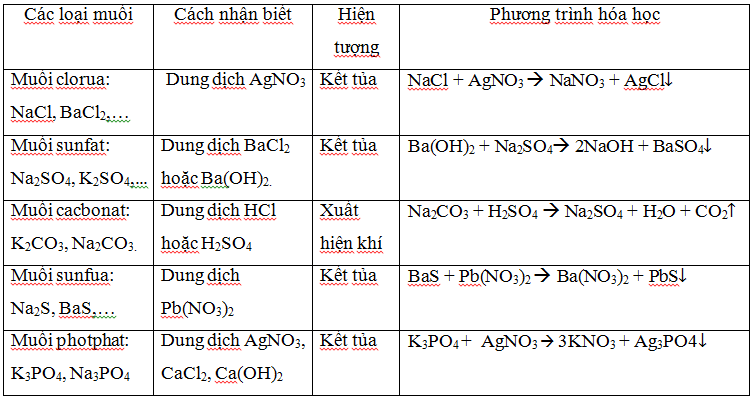
Nhận biết oxit kim loại.
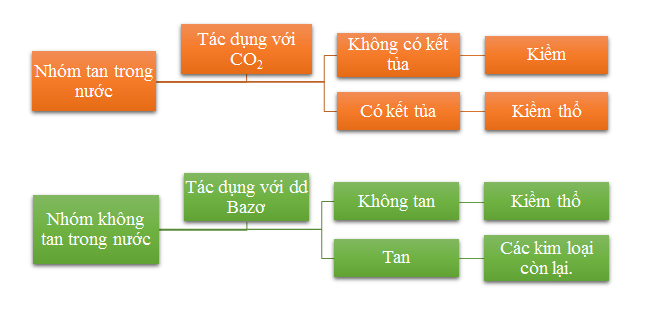
Đối với hỗn hợp oxit
Phương pháp nhận biết: Hòa tan từng oxit vào nước để chia thành nhóm oxit hòa tan và không hòa tan, có phương pháp nhận dạng riêng.
– Nhóm tan trong nước: dùng khí CO2 để nhận biết
- Nếu không có kết tủa: kim loại có trong oxit là kim loại kiềm.
- Nếu có kết tủa: kim loại có trong oxit là kim loại kiềm thổ.
– Nhóm không tan trong nước phản ứng với dung dịch bazơ.
- Nếu oxit không tan trong dung dịch kiềm thì kim loại chứa trong oxit là kim loại kiềm thổ.
- Nếu oxit tan trong dung dịch kiềm thì kim loại chứa trong oxit là Mg, Zn, Pb, Cu, Fe, Al (dựa vào phiếu thuộc da để xác định).
Một số loại bài tập
Dạng 1: Hình thức bài tập không hạn chế về thuốc thử và phương pháp sử dụng:
Giải pháp: Sử dụng bảng tính độ hòa tan hóa học hoặc những gợi ý ở phần trước.
Ví dụ:
Xác định 4 chai không dán nhãn chứa 4 dung dịch sau: NaCl, NaOH, Na 2 CO 3 , NaNO 3 .
Giải:
- Chia 4 dung dịch vào 4 ống nghiệm khác nhau và đánh số từ 1 đến 4.
- Cho quỳ đỏ vào 4 ống nghiệm, nếu dung dịch trong ống nghiệm chuyển sang quỳ tím thì đó là NaOH.
- Sau đó cho dung dịch AgNO3 vào 3 ống nghiệm chứa 3 dung dịch còn lại, dung dịch trong ống nghiệm có vẻ kết tủa, dung dịch này là NaCl.
PTHH: NaCl + AgNO 3 -> NaNO 3 + AgCl
- Cho dung dịch HCl vào ống nghiệm chứa 2 chất còn lại là Na 2 CO 3 và NaNO 3 , khí nào bay lên, chất này là Na 2 CO 3, chất nào không xuất hiện là NaNO 3 .
PTHH: Na 2 CO 3 + HCl -> NaCl + H 2 O + CO 2
Dạng 2: Loại bài tập hạn chế thuốc thử hoặc phương pháp sử dụng.
Phương pháp giải quyết:
- Đối với hình thức xét nghiệm sử dụng một thuốc thử bổ sung mà bạn chọn:
- Bước 1: Dùng chất bất kỳ để xác định một trong các chất nêu trong bài toán.
- Bước 2: Dùng chất đã xác định để xác định các chất còn lại.
- Đối với mẫu thử không sử dụng thuốc thử khác:
- Cách 1: Sử dụng tính chất vật lý của từng chất để phân biệt (mùi, màu sắc, độ hòa tan…)
- Cách 2: Dùng chất đã xác định để xác định các chất còn lại.
- Phương pháp 3: Có thể sử dụng phương pháp đun nóng nhẹ để xác định các chất dựa trên tính dễ bay hơi của chúng.
- Cách 4: Để các chất tương tác với nhau thì nhận biết theo hiện tượng của chúng.
Ví dụ 1: Chỉ sử dụng thêm một thuốc thử (tùy chọn), xác định 4 dung dịch trong lọ không nhãn sau: Na 2 CO 3 , Na 2 SO 4 , H 2 SO 4 và BaCl 2 .
Giải:
- Chia 4 dung dịch vào 4 ống nghiệm khác nhau được đánh số từ 1 đến 4.
- Cho quỳ tím vào mỗi ống nghiệm, dung dịch làm quỳ tím chuyển sang ống nghiệm là dung dịch H 2 SO 4 .
- Dùng dung dịch H 2 SO 4 vừa xác định cho vào 3 ống nghiệm chứa 3 chất còn lại.
- Chất có khí bay lên là Na 2 CO 3 .
PTHH: Na 2 CO 3 + H 2 SO 4 -> Na 2 SO 4 + H 2 O + CO 2
- Chất dường như kết tủa là BaCl 2 .
PTH: BaCl 2 + H 2 SO 4 -> BaSO 4 + 2HCl
- Chất nào không xuất hiện thì chất đó là Na 2 SO 4 .
Ví dụ 2: Không dùng thuốc thử khác, xác định bốn dung dịch sau: NaHCO 3 , CaCl 2 , Na 2 CO 3 , Ca(HCO 3 ) 2 .
Giải:
- Chia 4 dung dịch vào 4 ống nghiệm khác nhau được đánh số từ 1 đến 4.
- Chúng ta ghép các giải pháp lại với nhau, sau đó quan sát hiện tượng để xác định.
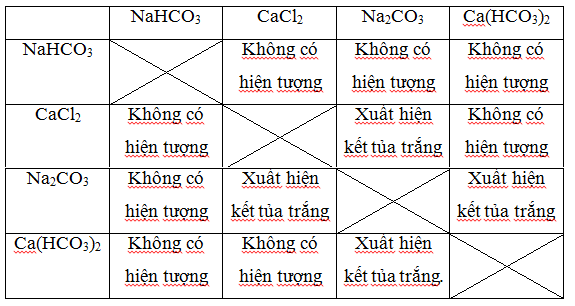
Qua bảng trên, ta thấy:
- Chất tạo ra kết tủa trắng nhiều gấp đôi là Na 2 CO 3 .
PTHH : Na2CO3 + CaCl2 -> 2NaCl + CaCO3
Na 2 CO 3 + Ca(HCO 3 ) 2 -> 2NaHCO 3 + CaCO 3
- Chất không tạo kết tủa là NaHCO3
- Chất tạo ra kết tủa màu trắng gồm có hai chất Ca(HCO 3 ) 2 và CaCl 2 .
- Sau đó, đun nóng nhẹ 2 dung dịch còn lại, dung dịch tạo kết tủa màu trắng và bay ra khí là Ca(HCO 3 ) 2 .
PTHH: Ca(HCO 3 ) 2 -> CaCO 3 + CO 2 + H 2 O
Một số cách ghi nhớ bảng tính tan
1. Axit: Hầu hết các axit đều tan trong nước, ngoại trừ axit silicic (H 2 SiO 3 ).
2. Bazơ: Hầu hết các bazơ đều không tan trong nước, ngoại trừ một số bazơ ít tan như: KOH, NaOH, Ba(OH) 2 và Ca(OH) 2 .
3. Muối:
- Các muối natri (Na) và kali (K) đều hòa tan.
- Muối nitrat (-NO 3 ) hòa tan.
- Hầu hết các muối clorua (-Cl), sunfat ( -SO4 ) đều hòa tan ngoại trừ AgCl (không tan), PbCl 2 (ít tan), BaSO 4 và PbSO 4 (không tan), Ag 2 SO 4 và CaSO 4. (hòa tan nhẹ).
- Hầu hết các muối cacbonat đều không hòa tan ngoại trừ K 2 CO 3 và Na 2 CO 3 (hòa tan).
Trên đây là tất cả các thông tin đầy đủ về hóa học axit, bazơ, muối hóa học lớp 8, 9, 10. Mong rằng bài viết này sẽ hữu ích với bạn.



